Astronomen der McMaster University und des Max-Planck-Instituts für Astronomie haben ein stimmiges Szenario für die Entstehung von Leben auf der Erde berechnet, das auf astronomischen, geologischen, chemischen und biologischen Modellen basiert. In diesem Szenario formt sich das Leben nur wenige hundert Millionen Jahre, nachdem die Erdoberfläche soweit abgekühlt war, dass flüssiges Wasser existieren konnte. Die wesentlichen Bausteine für das Leben wurden während der Entstehung des Sonnensystems im Weltraum gebildet und durch Meteoriten in warmen kleinen Teichen auf der Erde deponiert. Die neuen Ergebnisse wurden jetzt in den Proceedings der US National Academy of Sciences veröffentlicht.
Die Frage nach dem Ursprung des Lebens auf der Erde ist eine der grundlegenden Fragen der Wissenschaft. Wir haben zwar noch lange keine definitive Antwort auf diese Frage, aber in den letzten Jahrzehnten haben sich einige interessante Möglichkeiten ergeben. Eine davon wurde in den 1980er Jahren näher ausgearbeitet und postuliert eine “RNA-Welt”: Die genetische Information höherer Organismen wird in der Doppelhelix der DNA-Moleküle gespeichert. Aber es gibt auch eng verwandte Moleküle, RNA (Ribonukleinsäure), die eine herausragende Rolle in modernen Zellen spielen. Insbesondere katalysieren sie in den Zellen bestimmte chemische Reaktionen und sind für die Weiterleitung genetischer Informationen ebenso unentbehrlich wie für die Synthese spezifischer Proteine (sozusagen den Dekreten der Zell-Regierung) auf der Grundlage des genetischen Codes. Bei einigen Viren wird für die Speicherung der genetischen Information überhaupt keine DNA verwendet, sondern alle Informationen sind in Virus-RNA kodiert.
DNA und RNA
Die wichtigsten Bausteine von RNA und DNA sind die Nukleotide. In beiden Fällen bestimmt das Muster innerhalb der langen, langen Kette von Nukleotiden die in DNA und RNA kodierte Information. Für DNA wird die Abfolge von Nukleotiden manchmal als Zeichenkette ausgedrückt. Dabei steht jedes Zeichen für eine der vier möglichen Nukleobasen steht, jede davon charakteristisch für ein DNA-Nukleotid: A für Adenin, C für Cytosin, T für Thymin und G für Guanin (CGATTCACGATTACTACA…). In RNA-Molekülen wird Thymin durch Uracil, U, ersetzt. Ein weiterer Unterschied: Während DNA in der Regel als die bekannte Doppelspirale auftritt, hat die RNA vielfältigere Erscheinungsformen – am häufigsten sind einzelne Stränge von RNA, die in sich gefaltet sind und dabei recht komplizierte Formen annehmen können.
Die RNA ist für das Leben, wie wir sie kennen, lebensnotwendig, hat aber darüber hinaus Eigenschaften, die sie zu einem guten Kandidaten für frühere, primitivere Lebensformen machen – lange vor der Entstehung der ersten Zellen, ganz zu schweigen von multizellulären Organismen. Die wichtigste Eigenschaft ist die der Selbstreplikation: RNA kann die richtigen Nukleotide zusammensammeln und zu einer Kopie von sich selbst zusammenfügen.
Frühe RNA-Welt
Das vielversprechendste gegenwärtige Szenario für die Entstehung des Lebens ist die Bildung von Nukleotidketten in Form von RNA, die sich selbst replizieren. Einfache Zellvorläufer entstehen dann, wenn sich Fettsäuren spontan zu Membranen zusammenlagern (eine Reaktion, die in Laborexperimenten bereits beobachtet wurde) und damit kleine, abgeschiedene Taschen bilden, in deren geschütztem Inneren komplexere chemische Reaktionen ablaufen können. Aus diesen einfachen Ansätzen entwickelten sich im Laufe der Zeit dann komplexere Mechanismen, insbesondere die der DNA-Replikation.
Alle Komponenten dieses Szenarios sind derzeit spekulativ, und für jeden Schritt gibt es alternative Erklärungen und Modelle – auch für die Vorstellung einer RNA-Welt gibt es Alternativen. Aber wir leben in spannenden Zeiten, und es besteht eine realistische Hoffnung, dass sich in den nächsten Jahrzehnten eine Art Standardmodell für die Entstehung des Lebens etablieren wird. Der Fortschritt wird aber nicht nur phantasievolle Szenarien erfordern, sondern konkrete Berechnungen und Experimente, die zeigen, welche Evolutionswege möglich sind und welche nicht. Fortschritte betreffen dabei unterschiedliche Forschungsgebiete: Zum einen werden immer mehr Hypothesen über den Übergang vom Vorleben zum Leben experimentellen Tests zugänglich, da unser molekularbiologisches Wissen zunimmt. Auf der anderen Seite gibt es spannende neue Entwicklungen an der Schnittstelle von Molekularbiologie und Astronomie.
In den letzten Jahrzehnten haben die Astronomen nämlich beträchtliche Fortschritte gemacht, um zu verstehen, wie um junge Sterne herum Planetensysteme entstehen. Dieser Wissenszuwachs betrifft auch die Evolutionsgeschichte der Erde und unseres eigenen Sonnensystems. Die neuen Ergebnisse profitieren dabei von der Welle von Entdeckungen neuer Planeten um andere Sterne als die Sonne (Exoplaneten) sowie von direkten Beobachtungen junger Planetensysteme, die erst mit dem Aufkommen der neuesten Teleskopgeneration möglich geworden sind. Modelle der Planetenentstehung, einschließlich der chemischen Evolution neugeborener Planetensysteme, zeigen uns, welche Rahmenbedingungen unsere Erde für die Entstehung von Leben bot, und wie Leben in anderen Planetensystemen hätte entstehen können.
Wo Astronomie, Chemie und Biologie zusammenkommen
Eine Studie der Astronomen und Planetenentstehungs-Experten Ben Pearce, Ralph Pudritz, Dmitry Semenov und Thomas Henning bringt nun Astronomie und präbiotische Chemie zusammen, um Licht auf die früheste Ära der RNA-Welt zu werfen: die Prozesse, durch die sich kurze RNA-Moleküle zu längeren Molekülen zusammenschließen konnten (“Polymerisation”), welche sich dann in einer späteren Phase der chemischen Evolution selbstständig zu vermehren begannen.
Längere RNA-Moleküle hervorzubringen ist nicht einfach und erfordert genau definierte Bedingungen. Ein mögliches Szenario sind die ersten Schritte zum Leben in der Nähe hydrothermaler Quellen in der Tiefsee – Risse in der Erdkruste, aus denen Wasser strömt, welches durch die tieferen, heißeren Erdschichten erwärmt wurde. Es stellt sich jedoch die Frage, wie sich unter diesen Bedingungen längere Polymere bilden könnten; die Polymerisation scheint einen Zyklus von nassen und trockenen Bedingungen zu erfordern, wie er im Ozean nun einmal nicht gegeben ist. Ein weiteres Problem ist, wo unter diesen Bedingungen Stickstoff in geeigneter Form zur Verfügung stand, etwa in Form von Molekülen wie Cyanwasserstoff (HCN) oder Ammoniak, wichtig für die Bildung die Entstehung von Leben, wie wir es kennen.

Ein kleiner warmer Teich auf der heutigen Erde, auf dem Bumpass Hell Trail im Lassen Volcanic National Park in Kalifornien. Die kleinen warmen Teiche, in denen das erste Leben entstanden sein könnte, sahen vermutlich nicht unähnlich aus.
(Bild: B. K. D. Pearce)
Warme Teiche als Alternative
Eine attraktive Alternative für den Geburtsort des frühen Lebens auf der Erde sind “kleine warme Teiche”: seichte, stehende Gewässer, in denen sich Chemikalien konzentrieren und unter wesentlich günstigeren Bedingungen miteinander reagieren können als in der Tiefsee. Das gilt insbesondere für Teiche mit Wänden aus Ton oder anderen Mineralien, die bestimmte chemische Reaktionen begünstigen. Ein wichtiges Merkmal solcher Teiche sind Kreisläufe mit nassen und trockenen Phasen. Die entsprechenden Teiche würden immer einmal wieder austrocknen. Dabei werden die chemischen Inhaltsstoffe gehörig konzentriert, was Bindungen zwischen den Nukleotiden begünstigt. Später würde sich der Teich wieder mit Wasser füllen. Solche Zyklen dürften für die chemischen Reaktionen in solchen Teichen eine ganz entscheidende Rolle spielen. Der Ausdruck “kleiner warmer Teich”, „warm little pond“, geht übrigens auf eine der frühesten Spekulationen über den Ursprung des Lebens zurück: einen Brief von Charles Darwin an den Botaniker Joseph Hooker aus dem Jahr 1871.
Vor vier Milliarden Jahren dürften warme kleine Teiche allerdings noch vergleichsweise selten gewesen. Damals machteneOzeane einen sogar noch größeren Teil der Erdoberfläche aus als heute, und die ersten Kontinente, bestehend aus magmatischen Gesteinen aus dem Erdmantel, wie z.B. Basalte, tauchten gerade erst auf. Gewaltsame Vulkanausbrüche waren an der Tagesordnung, und die Atmosphäre wurde fast vollständig von vulkanischen Gasen dominiert. Woher könnten unter diesen Umständen die organischen Moleküle stammen, mit denen die Evolution der RNA-Welt ihren Ausgang nahm?
Lebensbausteine aus dem All
Eine plausible, vielleicht überraschende Antwort ist, dass die Bausteine für das erste Leben auf der Erde direkt aus dem Weltall stammen dürften. Die Scheiben aus Gas und Staub, die junge Sterne umgeben, enthalten beträchtliche Mengen an Ammoniak (NH3) und Blausäure (HCN); beides Moleküle, welche den für die Bildung von Nukleobasen notwendigen Stickstoff liefern können. Eisbedeckte Staubpartikel in den äußeren Bereichen solcher Scheiben erweisen sich als erstaunlich produktive chemische Mini-Laboratorien – tatsächlich zeigen Laborxperimente hier auf der Erde, wie sich Moleküle, die sich auf den eisigen Oberflächen solcher Staubkörner ansammeln, bei der Bestrahlung der Körner mit UV-Licht zu Nukleobasen verbinden; die Umgebung junger Sterne bietet dafür genau die richtigen Voraussetzungen.
In entsprechenden Experimenten konnte gezeigt werden, wie drei der fünf Nukleobasen (Uracil, Cytosin und Thymin) unter solchen Bedingungen spontan entstehen. Chemische Analysen an Meteoriten zeigen, dass diese in der Tat beträchtliche Mengen von drei der fünf Nukleobasen (Guanin, Adenin und Uracil) enthalten. Auch dafür, wie diese Nukleobasen während der Entstehung des Sonnensystems im Inneren der “Elternkörper” der Meteoriten, nämlich in großen Asteroiden, synthetisiert werden, gibt es Modellrechnungen.
Meteoriten und Staubteilchen als kosmischer Kurierdienst
Zurück zu den kleinen warmen kleinen Teichen. Diese bieten ideale Bedingungen für komplexere RNA-Moleküle, aber woher kommen die Grundbausteine, die Nukleobasen im Teich überhaupt? Die Chemie der umgebenden Atmosphäre, dominiert von Kohlendioxid (CO2), Stickstoffgas (N2), Schwefeldioxid (SO2) und Wasser (H2O), ist in dieser Angelegenheit wenig hilfreich. Unter den Bedingungen auf der frühen Erde (“schwach reduzierende Atmosphäre”) wird selbst der gelegentliche Blitzschlag, wie im berühmten Miller-Urey-Experiment zu den Ursprüngen organischer Moleküle, keine nennenswerte Menge an Nukleobasen produzieren.
Meteoriten, die auf die Erde fallen, sind da schon eine deutlich ergiebigere Quelle. Damals, vor etwa 4 Milliarden Jahren, war der Meteoritenbeschuss der Erde zwischen 100 Millionen und 100 Milliarden Mal intensiver als heute. Pro Jahr regneten zwischen einer Billion und einer Billiarde Kilogramm an Meteoritenmaterial auf die Erdoberfläche hernieder und deponierten dort geschätzte 2000 Kilogramm an unversehrten Kohlenstoffverbindungen, welche die kosmische Reise unbeschadet überstanden hatten.
Hinzu kommt ein Strom interplanetarischer Staubpartikel, die direkt auf die Erdoberfläche gelangen und ebenfalls die auf ihrer Oberfläche entstandenen chemischen Verbindungen mitbringen. Diese viel weniger spektakuläre Transportmechanismus ist beeindruckend effektiv und liefert geschätzte 60 Millionen Kilogramm intakter Kohlenstoffverbindungen pro Jahr.
Meteoriten-Lieferungen für warme Teiche: quantitative Rechnungen
Ein Szenario zu entwerfen, in dem Meteorite oder Staubpartikel Nukleobasen in kleinen warmen Teichen deponieren ist schön und gut. Aber eine wirkliche Erklärung liefert solch ein Modell nur, wenn es auch durch quantitative Daten gestützt wird.
Pearce und seine Kollegen haben für dieses Szenario ein detailliertes Modell berechnet. Aus einer rekonstruierten Geschichte der Einschlagkrater des Mondes leiteten sie drei mögliche Szenarien für Meteoriten-Bombardements der Erde ab – ein spätes Bombardementmodell, in dem ein heftiges meteoritisches Bombardement erst etwa 3,9 Milliarden Jahren vor unserer Zeit einsetzt, und zusätzlich zwei weitere Modelle, beide mit einem früheren Bombardements-Beginn rund 4,5 Milliarden Jahre vor unserer Zeit, je eines für die minimale und maximale Menge an deponiertem Meteorit-Material, die mit den Beobachtungsdaten vereinbar ist.
Anschließend berechneten die Forscher die Wahrscheinlichkeit, dass die kleinen warmen Teiche mit einem beträchtlichen Anteil an Kohlenstoff enthaltenden Meteoriten (kohligen Chondriten) “geimpft” wurden. Konkret brechen diese Meteoriten, die ursprünglich zwischen etwa 20 und 40 Meter Durchmesser haben, beim Durchqueren der Erdatmosphäre in kleine Stücke auseinander. Die Astronomen berechneten die Wahrscheinlichkeit, dass solche kleinen Stücke in der Nähe eines warmen kleinen Teiches auf der Erde landen würden (zwischen 1 und 10 Meter Teichmurchmesser), nahe genug für einen Teil ihres organischen Materials, um in den Teich zu gelangen. (Für diese Berechnung mussten die Forscher die Anzahl der warmen kleinen Teiche schätzen; dazu gingen sie davon aus, das solche Teilchen auf den Landmassen der Erde ungefähr so häufig sind wie heute; allerdings gab es den entsprechenden geologischen Entwicklungsmodellen insgesamt deutlich weniger Landfläche als heutzutage. Vorsichtshalber wiederholten die Forscher ihre Berechnung sowohl für zehnmal so viele Teiche als auch für ein Zehntel so viele Teiche.) Das Ergebnis ist, dass Tausende von feuchten kleinen Teichen auf diese Weise „geimpft“ und mit Lebensbausteinen versorgt worden wären.
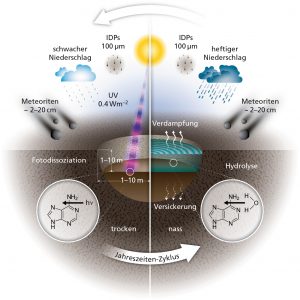
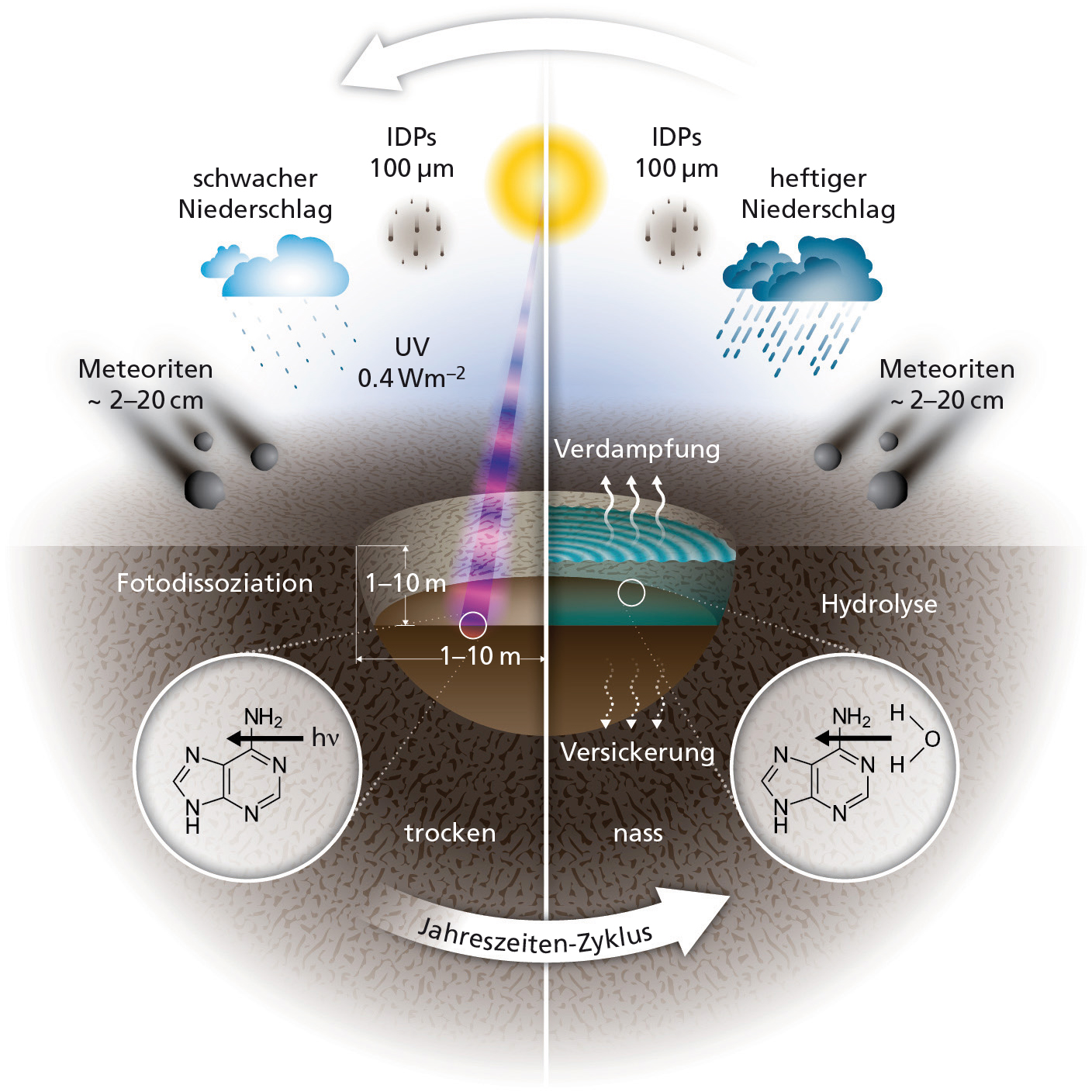
Schematische Darstellung der verschiedenen Einflüsse auf chemische Verbindungen in kleinen warmen Teichen im Wasser und während der Trockenphase: Materialnachschub durch Meteoriten und interplanetare Staubkörnern, Versickerung, Verdunstung, Wiederbefüllung durch Niederschlag, Hydrolyse komplexerer Moleküle und Photodissoziation durch UV-Photonen der Sonne.
(Bild: McMaster University)
Simulieren, was in kleinen warmen Teichen passiert
Was passiert mit den Nukleobasen, die per Meteorit oder Staubteilchen in einem solchen Teich angekommen sind? Eine ganze Reihe davon werden verloren gehen. Im Wasser des Teiches können sich Nukleobasen schlicht auflösen (Hydrolyse). Ein Teil des Wassers sickert durch Poren in der Basaltbasis des Teiches und nimmt dabei Nukleobasen mit, die anschließend natürlich an keinen weiteren chemischen Reaktionen im Teich teilnehmen. Während der Trockenphasen, wenn der Teich ausgetrocknet ist und seine Chemikalien als Sedimente abgelagert werden, spaltet die UV-Strahlung der Sonne Nukleobasen in einfachere Verbindungen (Photo-Dissoziation) – es sei denn, diese Nukleobasen werden zusätzlich durch eine Sedimentschicht geschützt.
Wenn einerseits fortwährend Nukleobasen verlorengehen, andererseits mit einer bestimmten Rate neues Material im Teich deponiert werden, ist klar, dass nur eine quantitative Rechnung zeigen kann, ob unter solchen Umständen in hinreichend vielen Teilchen hinreichend viele Nukleobasen übrig bleiben, um längere RNA-Ketten zu bilden.
Auch diese Rechnung haben Pearce und seine Kollegen durchgeführt – angesichts des unsicheren Wissens über die frühe Erde mit einer ganzen Reihe von Variationen an Umweltbedingungen, trockenere und feuchtere, heißere und kühlere. Diese Bedingungen beeinflussen nicht zuletzt, wie schnell oder langsam sich die Nukleobasen zu RNA-Ketten zusammenfinden.
Bausteinlieferung: Meteore, nicht Staubkörner
Das erste interessante Ergebnis der Studie ist, dass Meteore, nicht interplanetare Staubkörner, die Hauptquelle für jene Nukleobasen sind, welche die verschiedenen widrigen Bedingungen überleben. Der Grund dafür ist schlicht, dass die gleichmäßige Ablagerung von Staubkörnern in direktem Wettbewerb zu den Mechanismen des Nukleobaseverlustes steht, wie Versickerung und Photodissoziation. Meteoriten hingegen deponieren jeweils auf einen Schlag beträchtliche Menge an Nukleobasen. Das führt zumindest für eine kürzere Zeit zu höheren Nukleobasen-Konzentrationen im Teich.
Wie sich herausstellt, reicht die kürzere Zeit mit höheren Konzentrationen bereits aus, dass die Nukleobasen längere RNA-Moleküle bilden können. Diese wiederum gehen nicht so leicht verloren wie ihre kürzeren Verwandten. Insbesondere versickern längere RNA-Moleküle aufgrund ihrer Größe nicht durch typische Basaltporen. So können längere RNA-Moleküle, haben sie sich einmal gebildet, überleben, um anschließend an komplexeren chemischen Reaktionen teilzunehmen – und den Ausgangsstoff dafür liefern Meteorite, nicht der stetige, aber schwache Strom an einfallenden Staubpartikel aus dem Weltraum.
Warum Leben sich vergleichsweise schnell gebildet haben dürfte
Das Ablagerungsmodell hat interessante Konsequenzen für die Zeitskalen, auf denen Leben entstanden ist. Im Laufe der Zeit nimmt die Meteoritenrate nämlich schnell ab – für Leben, das aus deponiertem Meteoritenmaterial entstanden ist, gibt es damit nur ein vergleichsweise kurzes Zeitfenster. Die meisten der Nukleobasen-Lieferungen durch Meteoriten müssen ziemlich früh angekommen sein, bis etwa 4,17 Milliarden Jahre vor unserer Zeit. Demnach müsste sich die RNA-Welt auch schon früh gebildet haben, nämlich 200 bis 300 Millionen Jahre, nachdem sich die Erdoberfläche ausreichend abgekühlt hatte, um flüssiges Wasser zuzulassen – also Ozeane und Seen an der Erdoberfläche.
Wie gesagt, ist man noch weit davon entfernt, ein vollständiges, widerspruchsfreies und allgemein anerkanntes Modell für die Entstehung von Leben auf der Erde gefunden zu haben. Die jetzt von Pearce und seinen Kollegen veröffentlichte Berechnung dürfte aber bereits ein wichtiges Teil des Puzzles sein. Sie liefert den Nachweis, dass Meteoriten eine wichtige Rolle dabei gespielt haben dürften, um die Bausteine des Lebens auf die Erde zu bringen, und sie legt nahe, dass längere RNA-Stücke vergleichsweise früh in der Erdgeschichte entstanden sein dürfte. Damit wird das Szenario der Entstehung von Leben in kleinen, warmen Teichen deutlich gestärkt gegenüber dem konkurrierenden Szenario hydrothermaler Quellen in der Tiefsee.
Auf dem Weg zu einem Standardmodell der Lebensentstehung benötigt man all die quantitativen Analysen, die in die Arbeit von Pearce und Kollegen eingingen: Berechnungen, die unser Wissen über die Geologie der frühen Erde, die chemischen Bedingungen, die Eigenschaften der beteiligten Moleküle und astronomische Informationen über die Eigenschaften von Meteoriten und interplanetaren Stäuben miteinander verbinden, um uns zu sagen, welche der hypothetischen Schritte von einfachen Chemikalien bis hin zu selbstproduzierenden lebenden Zellen möglich sind und welche nicht.
Wir leben diesbezüglich in einer spannenden Zeit – dass solch eine quantitative Analyse nun erstmals möglich ist, verdanken wir Fortschritten auf vielen Gebieten: von der Mikrobiologie über die Suche nach Exoplaneten bis hin zu Beobachtungen planetarer Kinderstuben bei anderen Sternen. Nur dank all dieser Fortschritte können wir Spekulationen durch quantitative Analysen ersetzen.
Veröffentlichung:
, , , and Origin of the RNA world: The fate of nucleobases in warm little ponds PNAS 2017 ; published 2017. doi: 10.1073/pnas.1710339114
Pia Gaupels
Neueste Artikel von Pia Gaupels (alle ansehen)
- Der Stein, der Wolken macht - 10. Januar 2024
- Unterwasservulkane helfen, prähistorische Klimaerwärmung zu erklären - 4. August 2023
- Neuer Urwal ist ein Anwärter auf das schwerste Tier aller Zeiten - 3. August 2023